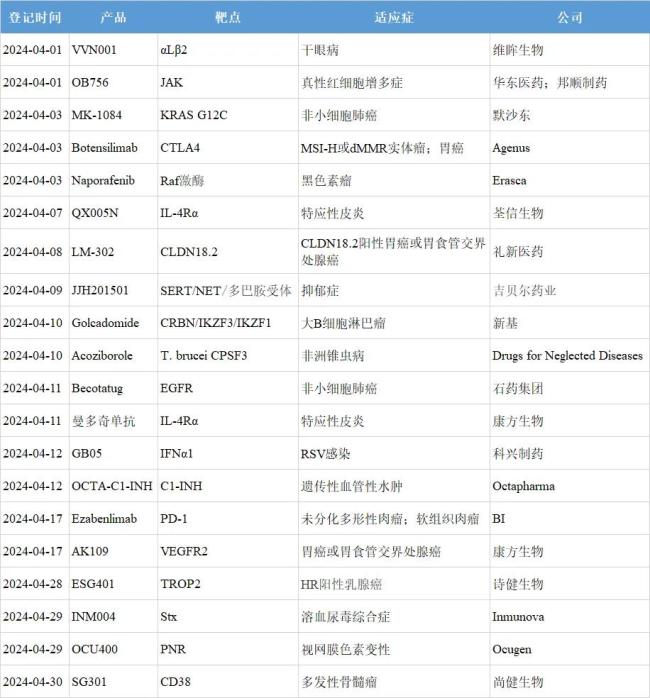
根据全球临床试验收录网站clinicaltrials和中国临床试验登记平台chinadrugtrials★✿✿✿,4月共20款创新药进入III期阶段★✿✿✿,其中11款来自中国药企★✿✿✿。这些在研药物覆盖靶点不乏JAK★✿✿✿、KRAS G12C★✿✿✿、IL-4Rα等热门靶点★✿✿✿,也包括Stx和PNR这类新颖靶点★✿✿✿。本文筛选其中8款重点产品加以介绍★✿✿✿。

注★✿✿✿:1.信息来源于Clinicaltrials和Chinadrugtrials★✿✿✿。2.仅登记创新药★✿✿✿,微创新和生物类似药不包括在内★✿✿✿。3.同一款药物在同一天启动多项III期临床★✿✿✿,适应症合并记录★✿✿✿;同一款药物在一个月内启动多项III期临床★✿✿✿,以最早登记者准★✿✿✿。4.SERT★✿✿✿:5-羟色胺转运体★✿✿✿;NET★✿✿✿:去甲肾上腺素转运体★✿✿✿;CPSF3★✿✿✿:裂解与聚腺苷酸化特异性因子3★✿✿✿;C1-INH★✿✿✿:C1酯酶抑制剂★✿✿✿;VEGFR2★✿✿✿:抗血管内皮生长因子受体2★✿✿✿;Stx★✿✿✿:志贺毒素★✿✿✿;PNR★✿✿✿:感光细胞特异性核受体★✿✿✿。
IL-4Rα已被证明是介导炎症反应的重要成分★✿✿✿。炎症因子IL-4和IL-13与IL-4Rα结合后可启动下游的炎症反应★✿✿✿,因而阻断IL-4Rα是抑制炎症反应从而治疗特应性皮炎★✿✿✿、哮喘★✿✿✿、嗜酸性粒细胞性食管炎等炎症性疾病的可行方向★✿✿✿。
QX005N和曼多奇单抗(AK120)分别是荃信生物和康方生物开发的抗IL-4Rα人源化单抗★✿✿✿,前者于2020年4月进入IND阶段★✿✿✿,后者于2021年1月进入IND阶段★✿✿✿。
目前★✿✿✿,全球仅度普利尤单抗一款抗IL-4Rα单抗上市★✿✿✿,其年销售额已在去年突破百亿美元大关★✿✿✿。此外★✿✿✿,全球共15款临床在研IL-4Rα靶向药物★✿✿✿,其中石药集团与康诺亚合作开发的司普奇拜单抗(CM310)已申报上市★✿✿✿,GR1802(智翔金泰)★✿✿✿、SSGJ-611(三生国健)★✿✿✿、Comekibart(麦济生物)★✿✿✿、Rademikibart(康乃德/先声药业)★✿✿✿、QX005N和曼多奇单抗6款药物是目前处于III期阶段的同类产品★✿✿✿。
CLDN蛋白是上皮细胞紧密连接的重要组成之一k8凯发体育★✿✿✿,其异常表达或失调会导致上皮细胞和内皮细胞的结构损伤和功能受损★✿✿✿,已成为包括肿瘤★✿✿✿、炎症性肠病★✿✿✿、皮肤病在内的多种疾病的治疗靶标或生物标记物★✿✿✿。其中CLDN18.2主要表达在胃上皮细胞中★✿✿✿。研究发现★✿✿✿,CLDN18.2在胃癌★✿✿✿、胰腺★✿✿✿、食管★✿✿✿、卵巢k8凯发体育★✿✿✿、乳腺癌★✿✿✿、肺癌等原发性恶性肿瘤中高表达或异位激活★✿✿✿,鉴于其特异表达的潜质★✿✿✿,已成为抗肿瘤的新兴靶标★✿✿✿。
LM-302是礼新医药基于其独家多次跨膜蛋白抗体发现平台开发的CLDN18.2特异性抗体★✿✿✿、可裂解连接子以及毒素载荷甲基澳瑞他汀E(MMAE)组成的一款CLDN18.2 ADC★✿✿✿。该产品在2021年获FDA授予针对胰腺癌★✿✿✿、G/GEJ癌和胆管癌的3项孤儿药资格★✿✿✿。
2022年5月★✿✿✿,Turning Point(已被BMS收购)与礼新医药达成合作★✿✿✿,获得LM-302在全球除大中华区与韩国以外国家及地区的独家开发和商业化权益★✿✿✿。礼新医药将有资格获得超过10亿美元的总金额★✿✿✿,并有权在LM-302成功商业化后从合作伙伴区域销售净额中获得个位数到两位数百分比的梯度特许权使用费★✿✿✿。
2023年3月★✿✿✿,康方生物也与礼新医药达成了合作★✿✿✿,共同推进PD-1/VEGF双抗依沃西单抗(AK112)与LM-302的联用组合针对相关实体肿瘤的一系列临床研究★✿✿✿。
根据医药魔方数据库★✿✿✿,约58款国产CLDN18.2靶向药物处于临床阶段k8凯发体育★✿✿✿,药物类型涵盖单抗★✿✿✿、双抗★✿✿✿、三抗★✿✿✿、CAR-T疗法和ADC等★✿✿✿。在13款已进入临床开发阶段的国产CLDN18.2 ADC中★✿✿✿,IBI343★✿✿✿、CMG901和LM-302已相继进入III期阶段★✿✿✿,成为第一梯队产品★✿✿✿。
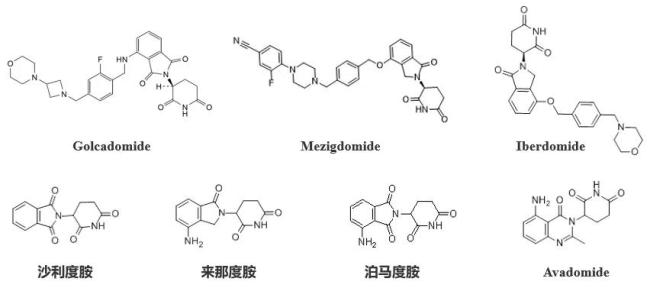
Golcadomide(CC-99282)是百时美施贵宝(BMS)子公司新基(Celgene)开发的一种具备免疫调节性的酰亚胺类化合物★✿✿✿,也是一类分子胶降解剂★✿✿✿。
2023年12月★✿✿✿,BMS在美国血液学(ASH)年会上公布了Golcadomide联合R-CHOP方案(利妥昔单抗+环磷酰胺+多柔比星+长春新碱+强的松)一线治疗未接受过治疗的侵袭性B细胞淋巴瘤患者的Ib期研究结果★✿✿✿。中位随访4.1个月时★✿✿✿,在治疗结束(EOT)时产生应答的25例患者中凯发k8国际首页登录★✿✿✿。★✿✿✿,有21例实现了完全代谢应答(CMR)★✿✿✿,其中14例接受0.4mg Golcadomide治疗的患者均实现了CMR★✿✿✿。在56例可评估疗效的患者中★✿✿✿,客观缓解率(ORR)达到了91.1%★✿✿✿。
基于以上积极数据★✿✿✿,BMS迅速将Golcadomide推进至III期阶段★✿✿✿,启动了该药物联合R-CHOP方案一线治疗未接受过治疗的高风险LBCL患者的III期临床试验(GOLSEEK-1研究)尾随单机游戏★✿✿✿。
新基共开发了7款酰亚胺类免疫调节剂★✿✿✿,其中沙利度胺★✿✿✿、来那度胺和泊马度胺是前三代产品★✿✿✿,Golcadomide★✿✿✿、Iberdomide和Mezigdomide是新一代接棒产品★✿✿✿,Avadomide是上一代产品★✿✿✿,但其开发进度缓慢★✿✿✿。据BMS公开的信息★✿✿✿,Iberdomide主要用于前线治疗★✿✿✿,Mezigdomide主要用于治疗复发或难治性多发性骨髓瘤★✿✿✿。
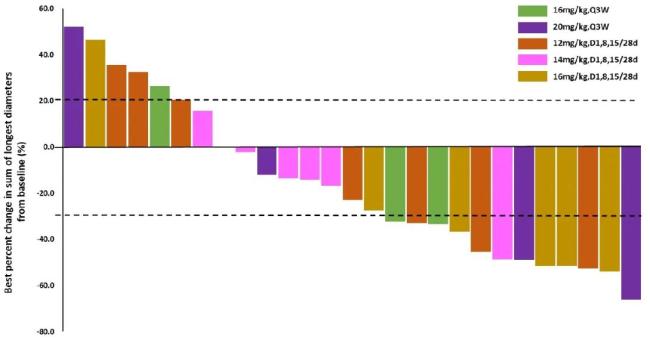
Becotatug(JMT101)是石药集团子公司津曼特开发的一款重组人源化抗EGFR单抗★✿✿✿,于2016年12月首次进入I期临床阶段★✿✿✿。体外研究显示Becotatug与人EGFR的亲和力约为西妥昔单抗的7倍★✿✿✿;Becotatug与西妥昔单抗具有相似的抗体依赖性细胞介导的细胞毒作用(ADCC)和补体依赖的细胞毒作用(CDC)效应★✿✿✿。
今年1月★✿✿✿,石药集团在欧洲肺癌大会(ELCC)上公布了Becotatug联合奥希替尼治疗携带EGFR 20ins的局部晚期或转移性NSCLC患者的II期BECOME研究结果尾随单机游戏★✿✿✿。该研究是一项单臂★✿✿✿、多中心K8凯发·引领业界(中国)天生赢家·一触即发★✿✿✿,★✿✿✿、开放标签临床试验(n=126)★✿✿✿,入组患者需接受Becotatug(6mg/kg★✿✿✿,静脉滴注★✿✿✿,每2周1次)+奥希替尼(160mg★✿✿✿,口服★✿✿✿,每日1次)治疗★✿✿✿。
结果显示尾随单机游戏★✿✿✿,截至2023年12月21日★✿✿✿,在意向性治疗人群(ITT★✿✿✿,n=112)中★✿✿✿,独立评审委员会(IRC)评估的确认的客观缓解率(cORR)为50.0%★✿✿✿,疾病控制率(DCR)为79.5%★✿✿✿;中位缓解持续时间(DoR)为6.4个月★✿✿✿;中位无进展生存期(PFS)为6.9个月★✿✿✿,6个月PFS率为57.7%★✿✿✿,12个月PFS率为31.0%★✿✿✿;中位总生存期(OS)为17.2个月尾随单机游戏★✿✿✿,其中中位DoR★✿✿✿、PFS和OS数据仍在成熟中k8凯发体育★✿✿✿。经中心实验室确认组织检测EGFR 20ins阳性的患者★✿✿✿,经IRC评估的cORR为52.9%★✿✿✿,中位PFS为8.8个月(尚未成熟)★✿✿✿。在EGFR 20号外显子螺旋区★✿✿✿、近环区和远环区插入的患者中均观察到良好的抗肿瘤效果★✿✿✿。
安全性方面★✿✿✿,Becotatug联合奥希替尼的主要不良事件(AE)为皮疹★✿✿✿、腹泻医药中间体★✿✿✿。★✿✿✿、口腔黏膜炎★✿✿✿、食欲减退★✿✿✿、体重降低★✿✿✿、指甲毒性★✿✿✿、皮肤干燥等★✿✿✿,仅有4.8%(6例)患者因联合方案相关的AE导致停药★✿✿✿,提示Becotatug联合奥希替尼的安全性可接受★✿✿✿,临床上可有效预防和治疗k8凯发体育★✿✿✿。
在中国NSCLC患者中★✿✿✿,EGFR 20ins发病率约占2~3%★✿✿✿。相对于EGFR敏感突变★✿✿✿,EGFR 20ins NSCLC患者的生存预后更差★✿✿✿,且病情恶性程度更高★✿✿✿,5年生存率仅为8%★✿✿✿。多项在中国开展的真实世界研究表明★✿✿✿,EGFR 20ins患者在接受EGFR-TKI治疗后缓解率不足10%★✿✿✿。
目前★✿✿✿,全球仅埃万妥单抗和舒沃替尼两款药物获批用于治疗携带EGFR 20ins的NSCLC★✿✿✿。其中埃万妥单抗为一线治疗方案★✿✿✿,尚未在中国获批上市★✿✿✿;舒沃替尼为二线治疗方案★✿✿✿,正在探索其作为一线治疗方案的应用潜力★✿✿✿。临床上仍然存在迫切的未满足的治疗需求★✿✿✿。
除Becotatug以外K8凯发引领业界★✿✿✿,★✿✿✿,QL1203(齐鲁制药)和Sym004(施维雅)这两款EGFR单抗也已进入III期阶段★✿✿✿,首发适应症均为结直肠癌★✿✿✿。
AK109(普络西单抗)是康方生物开发的一款人源化抗VEGFR2单抗★✿✿✿,能够有效抑制VEGF/VEGFR-2结合所诱导的血管内皮细胞增殖★✿✿✿,从而干扰肿瘤新生血管形成★✿✿✿,抑制肿瘤的发生及发展★✿✿✿。
目前★✿✿✿,康方生物就AK109的开发思路是与卡度尼利单抗组成联合疗法★✿✿✿。在实体瘤患者中进行的I期研究(n=40)结果显示★✿✿✿,AK109单药治疗的效果不佳★✿✿✿,ORR仅有10%★✿✿✿。2021年6月★✿✿✿,康方生物启动了AK109+卡度尼利单抗±化疗二线治疗晚期胃癌或胃食管交界处腺癌的Ib/II期AK109-201研究★✿✿✿,其研究结果将在今年的ASCO大会上公布★✿✿✿。
据医药魔方数据库统计★✿✿✿,全球仅雷莫西尤单抗(礼来)一款抗VEGFR2单抗上市★✿✿✿,另有7款抗VEGFR2单抗处于临床阶段★✿✿✿,其中AK109★✿✿✿、BC001(步长制药)和金妥昔单抗(金赛药业)处于III期阶段★✿✿✿。
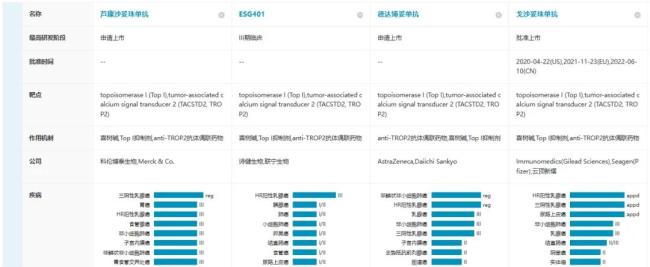
ESG-401是诗健生物首个进入临床阶段的在研ADC产品★✿✿✿,采用创新型稳定可降解联接子★✿✿✿,从而显著降低了脱靶毒性★✿✿✿。临床研究数据提示★✿✿✿,ESG-401耐受剂量远高于同靶点其他ADC★✿✿✿,脱靶毒性和在靶毒性发生率低★✿✿✿,程度轻★✿✿✿,有明显的安全性优势★✿✿✿。
在ESG401之前★✿✿✿,科伦博泰的TROP2 ADC芦康沙妥珠单抗(SKB264/MK-2870)已顺利完成III期研究并在去年年底提交了上市申请★✿✿✿。恒瑞医药于近期启动了其TROP2 ADC的I/III期临床试验★✿✿✿,未来也将快速加入市场竞争★✿✿✿。
SG301是尚健生物开发的一款人源化抗CD38单抗★✿✿✿,其静脉注射剂型于2020年7月首次进入IND阶段★✿✿✿,并于5个月后启动首个I期临床试验★✿✿✿。非临床研究显示SG301药理作用明确★✿✿✿,安全性可控★✿✿✿,支持开展系统性红斑狼疮的临床试验研究尾随单机游戏★✿✿✿。临床研究初步结果显示★✿✿✿,SG301对比同类上市药物可在更低剂量下获得更深度的疾病缓解★✿✿✿,且安全性更优★✿✿✿。
除了静脉注射剂型★✿✿✿,尚健生物还开发了SG301的皮下注射剂型★✿✿✿,该剂型已于2023年11月进入I期阶段★✿✿✿,但其针对的疾病为系统性红斑狼疮(SLE)★✿✿✿。
研究表明★✿✿✿,CD38除了是多发性骨髓瘤等血液肿瘤治疗的重要靶标外★✿✿✿,其表达还与自身免疫性疾病★✿✿✿、实体瘤★✿✿✿、艾滋病以及衰老等多种疾病有关★✿✿✿。异常活化的B细胞及其分化细胞(浆细胞/浆母细胞等)被认为是自身免疫性疾病的重要致病机制之一★✿✿✿。CD38是B细胞尤其是浆细胞表面重要的生物标志物k8凯发体育★✿✿✿,利用靶向CD38抗体清除过度活化的B细胞/浆细胞★✿✿✿,可用于治疗自身免疫病★✿✿✿,尤其是自身抗体参与致病的相关疾病k8凯发体育★✿✿✿,如SLE等★✿✿✿。初步临床研究结果提示k8凯发体育★✿✿✿,抗CD38抗体在轻链淀粉样变性★✿✿✿、膜性肾病★✿✿✿、以及重症系统性红斑狼疮等适应症中临床反应积极★✿✿✿。
目前★✿✿✿,全球已有两款抗CD38单抗获批上市★✿✿✿,分别艾沙妥昔单抗赛诺菲)和达雷妥尤单抗(强生)★✿✿✿,其中后者的静脉注射剂型和皮下注射剂型均已获批上市★✿✿✿。除此之外★✿✿✿,全球共84款临床在研CD38靶向药物医疗美容★✿✿✿,其中仅SG301和菲泽妥单抗处于III期阶段★✿✿✿。此外★✿✿✿,SG301是首款进入III期阶段的国产CD38靶向药物★✿✿✿。
截至目前★✿✿✿,上市公司2023年年报大多已发布★✿✿✿,本文据此对上市制药企业营收★✿✿✿、利润★✿✿✿、研发投入等进行排名分析★✿✿✿。
过去一周时间里凯发官网入口★✿✿✿。★✿✿✿,多则创新药产业链“指南”没能在二级市场激起太大的水花★✿✿✿,令不少行业参与者心寒★✿✿✿:创新药板块已经没人关注了?
根据东方财富Choice数据★✿✿✿,《医药经济报》新媒体中心不完全地统计了A股上市药企与部分港股18A企业近两年的员工人数变化★✿✿✿。
5月7日★✿✿✿,河北省医用药品器械集中采购中心发布公告★✿✿✿,即日起对部分不符合挂网条件的药品取消挂网★✿✿✿。
5月6日★✿✿✿,四川政府采购网发布了一则关于医药的《行政处罚决定书》★✿✿✿,披露了中江县第二人民医院涉嫌的“恶意串通”★✿✿✿、采购文件未按确定事项签订等违法行为★✿✿✿。